Toute entreprise souhaitant commercialiser des médicaments de thérapie innovante (MTI) au sein de l'Union européenne doit être titulaire d'une autorisation de mise sur le marché délivrée par la Commission européenne.
Le droit de l'Union européenne offre différentes possibilités pour obtenir une autorisation de mise sur le marché via des mécanismes réglementaires spécifiques visant à faciliter un accès rapide des patients aux médicaments, y compris aux MTI, tout en maintenant une évaluation rigoureuse de la qualité de ces médicaments, ainsi que de leur sécurité et de leur efficacité en regard du rapport bénéfice/risque.
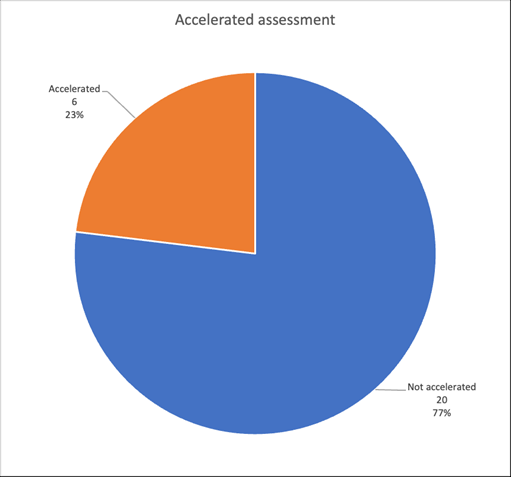
L’évaluation accélérée est un outil procédural qui permet au demandeur de réduire la période d'examen d’une demande d'autorisation de mise sur le marché centralisée de 210 à 150 jours maximum, sans tenir compte des arrêts d'horloge. Un demandeur peut solliciter une évaluation accélérée pour des médicaments s'ils présentent un intérêt majeur de santé publique, notamment du point de vue de l'innovation thérapeutique. La demande doit être dûment motivée et son acceptation est décidée par le Comité des médicaments à usage humain (CHMP). (Article 14(9) du Règlement (CE) N° 726/2004). Néanmoins, la décision sur l’évaluation accélérée n'a pas d'impact sur l'avis futur du CHMP concernant l'octroi d'une autorisation de mise sur le marché.
L’évaluation accélérée est particulièrement adaptée aux MTI, dont une des caractéristiques est d'être innovant (Figure 1).