Aucun médicament ne peut être légalement commercialisé dans l'Union européenne sans autorisation de mise sur le marché. Pour les Médicaments de Thérapie Innovante (MTi), la voie standard d'autorisation de mise sur le marché est la procédure d'autorisation de mise sur le marché appelée « procédure centralisée ».
Cependant, trois procédures réglementaires supplémentaires existent pour accélérer l'accès au marché des produits soumis à une procédure d’autorisation centralisée, ainsi que des programmes réglementaires établis par l'Agence européenne des médicaments (EMA, de l’anglais European Medicines Agency) afin d'accélérer l'accès aux médicaments en Europe en facilitant les processus de recherche et de développement.
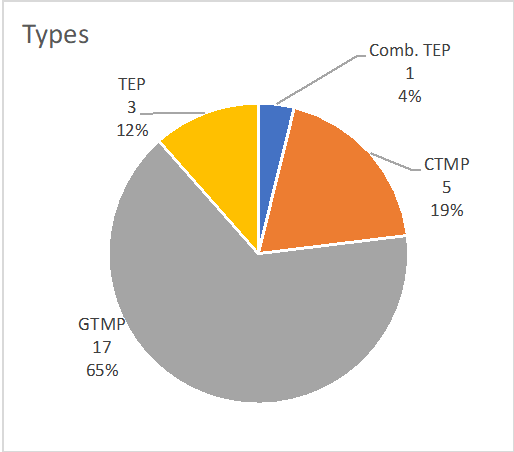
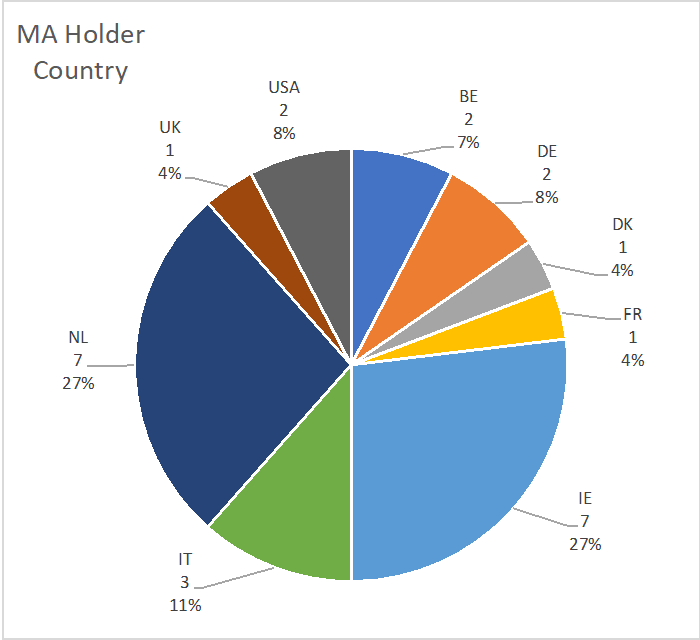
La répartition par pays des titulaires d'AMM de MTI est la suivante : NL 7 (27%), IE 7 (27%), BE 2 (7%), DE 2 (8%), IT 3 (8%), UK 2 (11%), USA 2 (8%), DK 1 (4%). Abréviations : BE : Belgique ; DE : Allemagne ; DK : Danemark ; IE : Irlande ; IT : Italie ; NL : Pays-Bas ; UK : Royaume-Uni ; USA : États-Unis d'Amérique.